Дитионит натрия
| Дитионит натрия | |
|---|---|
 | |
 | |
| Общие | |
| Систематическое наименование |
Дитионит натрия |
| Традиционные названия | Тетраоксодисульфат натрия |
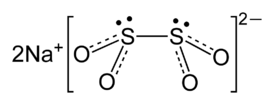
| Хим. формула | Na2S2O4 |
| Физические свойства | |
| Состояние | бесцветные (белые) кристаллы |
| Молярная масса | 174,11 г/моль |
| Плотность | 2,19 г/см³ |
| Химические свойства | |
| Растворимость | |
| • в воде | 24,1 г/100 мл |
| Классификация | |
| Рег. номер CAS | 7775-14-6 |
| PubChem | 24489 |
| RTECS | JP2100000 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Дитионит натрия — неорганическое соединение, соль щелочного металла натрия и неустойчивой дитионистой кислоты с формулой Na2S2O4, бесцветные (белые) кристаллы, растворимые в воде, образует кристаллогидрат. Ранее для него использовали неправильное название гидросульфит натрия.
Получение
- Восстановление цинком свежеобразованного сульфита натрия при низких температурах:
- [math]\displaystyle{ \mathsf{2NaOH + 2SO_2 + Zn \ \xrightarrow{0^oC}\ Na_2S_2O_4 + Zn(OH)_2\downarrow } }[/math]
- Действием диоксида серы на амальгаму натрия при низкой температуре:
- [math]\displaystyle{ \mathsf{2SO_2 + 2Na_{Hg} \ \xrightarrow{10^oC}\ Na_2S_2O_4 } }[/math]
- Действием борогидрида натрия на сернистый газ в щелочной среде:
- [math]\displaystyle{ \mathsf{Na[BH_4] + 8NaOH + 8SO_2 \rightarrow 4Na_2S_2O_4 + NaBO_2 + 6H_2O} }[/math]
- Электролиз раствора гидросульфита натрия при низкой температуре:
- [math]\displaystyle{ \mathsf{4NaHSO_3 \ \xrightarrow{0^oC, e^-}\ 2Na_2S_2O_4 + O_2\uparrow + 2H_2O } }[/math]
Физические свойства
Дитионит натрия образует бесцветные (белые) кристаллы.
Образует кристаллогидрат состава Na2S2O4•2H2O.
Химические свойства
- Разлагается при нагревании:
- [math]\displaystyle{ \mathsf{2Na_2S_2O_4 \ \xrightarrow{52^oC}\ Na_2SO_3S + Na_2S_2O_5 } }[/math]
- Безводную соль получают сушкой кристаллогидрата в этаноле:
- [math]\displaystyle{ \mathsf{Na_2S_2O_4\cdot 2H_2O \ \xrightarrow{40-50^oC}\ Na_2S_2O_4\downarrow + 2H_2O } }[/math]
- Разлагается горячей водой:
- [math]\displaystyle{ \mathsf{2Na_2S_2O_4 + H_2O \ \xrightarrow{T}\ 2NaHSO_3 + Na_2SO_3S } }[/math]
- Разлагается кислотой на холоде и при комнатной температуре:
- [math]\displaystyle{ \mathsf{Na_2S_2O_4 + 2HCl \ \xrightarrow{0^oC}\ 2NaCl + H_2S_2O_4 } }[/math]
- [math]\displaystyle{ \mathsf{2Na_2S_2O_4 + 2HCl + H_2O \ \xrightarrow{20^oC}\ 3NaHSO_3 + S\downarrow + NaCl } }[/math]
- Окисляется кислородом воздуха:
- [math]\displaystyle{ \mathsf{2Na_2S_2O_4 + O_2 \ \xrightarrow{}\ 2Na_2S_2O_5 } }[/math]
- В растворе легко окисляется кислородом воздуха:
- [math]\displaystyle{ \mathsf{2Na_2S_2O_4 + O_2 + 2H_2O \ \xrightarrow{}\ 4NaHSO_3 } }[/math]
- Восстанавливает малоактивные металлы:
- [math]\displaystyle{ \mathsf{Na_2S_2O_4 + 2AgNO_3 \ \xrightarrow{}\ 2Ag\downarrow + 2SO_2\uparrow + 2NaNO_3 } }[/math]
Применение
Находит применение как сильный восстановитель в химии и производстве красителей.
Литература
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
